法规介绍
消毒产品的定义
根据《中华人民共和国传染病防治法》第七十八条的规定,消毒是指用化学、物理、生物的方法杀灭或者消除环境中的病原微生物。
在作用目的上,它是一种防病的产品,而不是治病或诊断疾病的产品;在作用机理上,它是一种用化学、物理、生物的方法消除病原微生物的产品,而不是用药理学或免疫学的方法预防疾病的产品;在作用对象上,它是针对环境中的病源微生物,而不是针对人的疾病的一种产品。
根据《消毒管理办法》第四十六条的规定,消毒产品包括消毒剂、消毒器械(含生物指示物、化学指示物和灭菌物品包装物)、卫生用品和一次性使用医疗用品。
主要内容
消毒产品的分类及管理
中国对消毒产品按照用途、使用对象的风险程度实行分类管理。产品责任单位应当在第一类、第二类消毒产品首次上市钱自行或委托第三方进行卫生安全评价,并对评价结果负责。卫生安全评价合格的消毒产品方可上市销售。
第一类:具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤黏膜消毒剂,生物指示物、灭菌效果化学指示物。
第二类:具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂。
第三类:风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。
注:同一个消毒产品涉及不同类别时,应当以较高风险类别进行管理。
实施备案的法律依据:
《消毒管理办法》、《消毒产品卫生安全评价规定》、《新消毒产品和新涉水产品卫生行政许可管理规定》等
主管当局:
各省(市、区)卫生和计划生育委员会
消毒品备案流程图
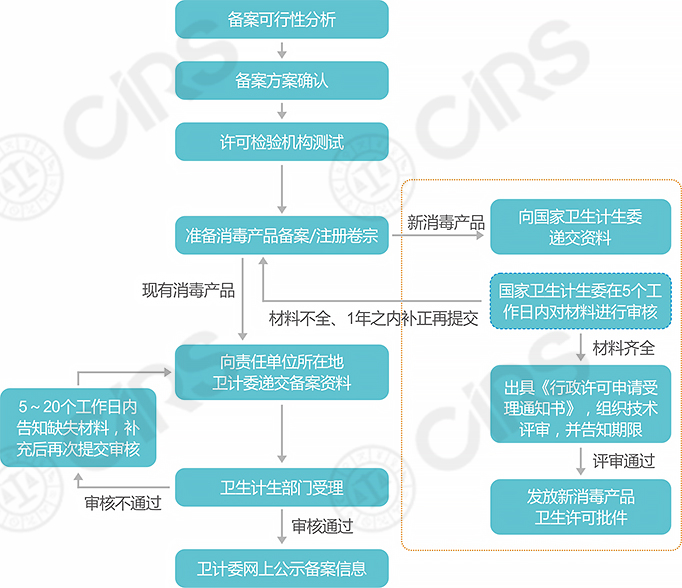
- 备案资料要求
消毒产品备案资料一般为消毒产品安全评价报告备案登记表、消毒产品卫生安全评价报告、标签、说明书、检测报告等基本资料,对于国产产品还需国产消毒产品企业卫生许可证,对于进口产品还需要有进口产品生产国(地区)允许生产销售的证明文件等资料。
- 备案测试要求
消毒产品备案的产品检验报告,由有资质的检验机构出具,应当符合《消毒产品卫生安全评价技术要求》等相关法规的规定。产品检验报告包括:
- 微生物污染指标实验
- 理化实验
- 毒理学试验
- 微生物杀灭或抗抑菌实验报告等。
所有检验项目应使用同一个批次产品完成,补做检验项目的可使用不同批次,并重新测定有效成分含量、pH值,其中有效成分为非单纯化学成分的产品应重新测定一项抗力最强的微生物杀灭(或抑制)试验和pH值。
上市后的消毒产品有以下情形改变的,产品责任单位应对相关检验项目重新检测并更新评价资料:
a)实际生产地址迁移、另设分厂或车间、转委托生产加工的;
有a)情形的,消毒剂和抗(抑)菌制剂应进行有效成分含量、原液稳定性试验、pH值测定;消毒器械应进行主要杀菌因子强度测定,不具备杀菌因子测定条件的应进行模拟现场试验;生物指示物应进行含菌量测定,化学指示物应进行颜色变化情况测定,带有灭菌标识的灭菌物品包装物应进行灭菌因子穿透性能测定。
b)消毒剂、抗(抑)菌制剂、生物指示物、化学指示物、带有灭菌标识的灭菌物品包装物及PCD 延长产品有效期的;
有b)情形的,消毒剂和抗(抑)菌制剂应进行有效成分含量、pH值、一项抗力最强的微生物杀灭(或抑制)试验和稳定性试验;使用原送检样品的应做稳定性试验。生物指示物、化学指示物、PCD应进行稳定性试验;带有灭菌标识的灭菌物品包装物应进行包装材料有效期试验。
c)消毒剂、消毒器械和抗(抑)菌制剂增加使用范围或改变使用方法的;
有 c)情形的,应进行相应的理化、微生物杀灭(或抑制)和毒理试验。
d)第一类消毒产品卫生安全评价报告四年有效期满前。
有d)情形的,消毒剂应进行有效成分含量、pH值和一项抗力最强的微生物杀灭试验,消毒器械应进行主要杀菌因子强度和一项抗力最强的微生物杀灭试验,生物指示物应进行含菌量的测定,灭菌效果化学指示物应进行颜色变化情况的测定。
- 备案标签要求
根据《消毒产品标签说明书通用要求》,消毒产品最小销售包装标签应当至少包括以下内容:
- 产品名称;
- 净含量;
- 产品规格;
- 主要有效成分及其含量;
- 使用范围;
- 生产日期及有效期或生产批号及限期使用日期;
- 生产企业的名称、地址、联系方式;
- 国产产品生产企业卫生许可证号;
- 进口产品原产国或地区名称;
- 贮存条件。
我们的服务
- 中国消毒产品备案
- 企业标准编写及标签制作
- 在华责任单位
- 法规咨询/报告/培训
- 其他国家消毒产品合规服务(欧盟、美国等)
- 家用护理品合规审核/检测及标签制作
- 产品清关
我们的优势
- 为消毒产品企业提供一站式服务
- 产品安全和合规
- 产品快速投放市场
- 拥有丰富经验的专业法规团队
- 全球化的合作伙伴
- 严格的保密制度
我们的其他服务:
