创新医疗器械注册申报
依据《创新医疗器械特别审查程序》及医疗器械相关法规规定,国内外创新医疗器械注册人在确保产品安全、有效的前提下,提交相应技术资料及证明性文件,提出创新医疗器械特别审查申请,进入创新医疗器械特别审查程序的注册申请,审评早期介入并有专人负责,在产品检测、体系核查及技术审评优先安排。
创新医疗器械适用条件
1. 申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权,创新医疗器械特别审查申请时间距专利授权公告日不超过5年;或者核心技术发明专利的申请已由国务院专利行政部门公开,并由国家知识产权局专利检索咨询中心出具检索报告,报告载明产品核心技术方案具备新颖性和创造性。
2. 申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
3. 产品主要工作原理或者作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,且具有显著的临床应用价值。
创新医疗器械申报流程
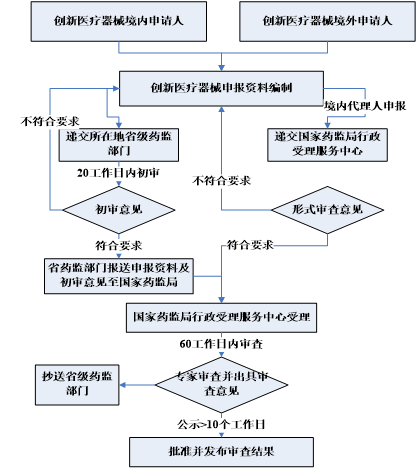
创新医疗器械特别审查申请资料要求
1. 创新医疗器械特别审查申请表
2. 申请人企业资质证明文件
3. 产品知识产权情况及证明文件
4. 产品研发过程及结果综述
5. 产品技术文件,如产品适用范围及预期用途、产品工作原理或作用机理、产品主要技术指标及确定依据、主要原材料及关键元器件的指标要求、主要生产工艺过程及流程图、主要技术指标的检验方法等。
6. 产品创新的证明性文件
7. 产品风险分析资料
8. 产品说明书(样稿)
9. 其它证明产品符合创新医疗器械的资料
10. 所提交资料真实性的自我保证声明
我们的服务
医疗器械创新性确认
创新医疗器械申报资料编制与审核
创新医疗器械特别审查申请与跟进
创新医疗器械注册申报与跟进
