新冠病毒侵入人体后,人体会产生相应的特异性抗体进行防御。其中特异性抗体IgM最早产生并进行早期防御,但该抗体维持时间短,消失快,在血中持续数日至数周;随后产生IgG抗体,在IgM接近消失时,IgG的含量达到高峰,并在血中持续较长时间。在临床应用中,因新冠病毒特异性IgG在病毒感染早期检出率较低,因此该标志物不单独用于新冠病毒感染的辅助诊断,应与新冠病毒特异性IgM抗体检测联合使用。
1、新冠抗体检测试剂临床试验指导原则及标准
序号 | 指导原则/标准名称 | 发布时间 |
1 | 《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号) | 2021-08-31 |
2 | 《新型冠状病毒(2019-nCoV)抗体检测试剂注册审查指导原则》 | 2022-04-27 |
3 | 《体外诊断试剂临床试验技术指导原则》 | 2021-09-16 |
4 | 《新型冠状病毒感染的肺炎诊疗方案》 | 2022-03-15 |
5 | 《新型冠状病毒感染的肺炎实验室检测技术指南》 | 2020-09-16 |
2、临床试验要求
目录 | 具体要求 |
机构与伦理 要求 | (1) 新冠病毒抗体检测试剂临床试验应按要求在3家以上(含3家)临床试验机构进行; (2) 开展临床试验的机构应按要求经国家药品监督管理局医疗器械临床试验机构备案系统备案。 |
(3) 有伦理委员会或区域伦理的,提供伦理批件(时间在报告之前即可); (4) 无伦理委员会的,机构出具无伦理委员会的声明,并声明允许在本机构开展临床试验。 | |
(5) 注意事项:定点医院;目标人群,样本量充足;确诊与排除病例全部涵盖;病例背景信息齐全且能够提供;能够配合临床试验伦理及签章。 | |
临床试验设计要求 | (6) 研究类型:该类产品预期用途一般为新冠病毒感染肺炎的辅助诊断,临床试验为观察性研究。 |
(7) 研究方式(两种): ① 选择与已上市同类产品进行临床检测结果的一致性比对; ② 或与临床参考标准进行比较研究; | |
(8) 注意事项: ① 如临床试验选择与已上市同类产品进行一致性比对,在同类产品选择的过程中应注意产品适用样本类型、检测方法学、检测性能等方面应与试验体外诊断试剂具有较好的可比性。 ② 如果临床试验选择与临床参考标准进行比较研究,则临床试验中应选择临床上新型冠状病毒感染的肺炎诊断标准及疾病进程的判定结果作为对比。建议同时参考诊断所用核酸检测结果,以利于抗体检测试剂临床性能的充分评价。 | |
入组人群 要求 | (9) 临床试验的入组人群应为产品的预期适用人群,用于未接种过新冠病毒疫苗及既往未感染过新冠病毒的疑似病例。 |
样本量 要求 | (10) 分两种: ① 如临床试验采用试验用体外诊断试剂与已上市同类产品进行比对的试验设计,建议对比试剂检测阳性样本不少于200例(不同疾病进程患者:发病初期、中期、治疗后期/恢复期,各50+;部分确诊患者连续样本:含核酸和抗原/抗体阳转的各阶段样本,30+),阴性样本不少于300例。 ② 如临床试验采用试验体外诊断试剂与临床参考标准进行比对研究。 针对确诊病例,每一疾病阶段(早期、中期和后期)病例数不少于70例。针对排除病例,排除病例不少于300例。 |
临床评价资料形式及要求 | (11) 申请人应按照相关法规文件要求提交临床评价综述、各机构伦理审查意见、临床试验方案和临床试验小结以及临床试验总结报告。 |
(12) 按eRPS提交要求准备资料 ① 签字盖章符合法规要求; ② 数据表内容符合要点要求; ③ 注意明确发病日期、样本采集日期、发病到样本采集天数、病程阶段、核酸检测结果、确诊/排除结论、疾病背景信息。 ④ 疾病背景信息:应与新冠疾病相关,能够判断为疑似病例。 | |
临床试验数据汇总表 | (13) 临床试验数据汇总表作为临床试验报告的附件提交。 ① 数据表中应包括检测病例的编号、年龄、性别、样本类型、采集时间、临床诊断背景信息、本产品检测结果及新型冠状病毒感染的确诊或排除结果等,同时请明确疾病确诊所采用的核酸检测结果(包括核酸检测试剂名称)。 ② 临床应用的数据集中每一病例编号应能够溯源。鉴于抗原、抗体的产生与病原体感染病程密切相关,建议在临床背景信息中详述患者发病时间、症状变化、疾病转归等(具体要求参见下表) |
3、临床实验数据汇总表
受试者编号 | 年龄 | 性别 | 样本类型 | 确诊/排除结果 | 临床诊断背景信息 | 考核试剂检测结果 | 核酸检测结果 | 采样时间 |
备注: a)原则上每个病例均应明确确诊/排除结果,如有核酸检测为阴性且具有肺炎影像学特征,无法排除的病例应在确诊/排除结果一栏特别注明。 b)确诊病例应明确采样时间点的病程阶段:初期、中期或治疗后期/恢复期等。 c)受试者编号应唯一可溯源。 | ||||||||
附:
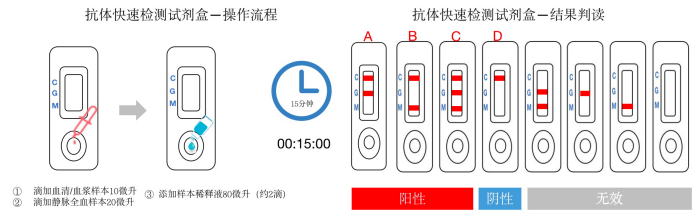
结果判读解释
A | IgM阴性+IgG阳性 | 阳性,既往感染 |
B | IgM阳性+IgG阴性 | 阳性,感染早期 |
C | IgM阳性+IgG阳性 | 阳性,现症感染 |
D | IgM阴性+IgG阴性 | 正常 |
