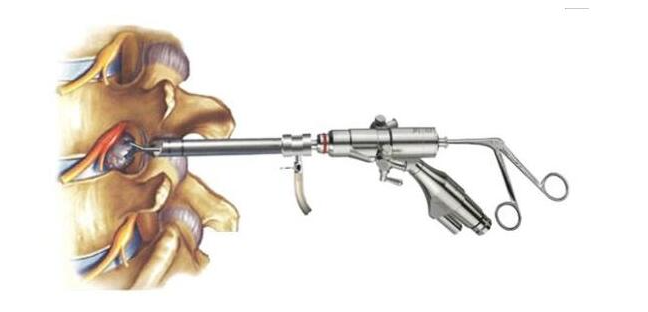
一、椎间孔镜概况
椎间孔镜是有创类硬性光学内窥镜,硬性光学内窥镜是一个含有传输照明光路和光学成像系统的硬性内窥镜,外部照明光可经由照明光路进入人体内,患者体内的情况可通过成像系统在外部成像或由医生直接目视观察。硬性内窥镜是内窥镜进入人体部分无法顺着自然孔道或者创建的外科切口或者其他器械通道弯曲的内窥镜。
椎间孔镜结构一般包括椎间孔镜主体、镜管、光源光缆接口、进出水接口、器械通道和目镜罩。
二、对比器械选择
对比器械的选择可选用一个或多个同品种产品进行比对,宜优先选择与申报产品适用范围相同、技术特征相同或尽可能相似的产品作为同品种产品。椎间孔镜的技术特征主要包括光学参数和机械参数,光学参数影响最终成像效果,机械参数影响操作性能。因此选择对比器械时应综合考虑,选择最接近的产品进行同品种评价。
三、对比项目
椎间孔镜 | 对比项目 |
1.工作原理 | |
2.结构组成 关注:结构的差异。 | |
3.生产工艺 关注:是否有特殊的工艺。 | |
4.与人体接触部分的制造材料(如种类、材料牌号、成分、符合的标准等信息) 关注:是否有不同的材料或者成分的差异。 | |
5.性能要求 关注:光学性能、机械性能等,参考YY 0068.1—YY 0068.4中性能参数要求,体现差异的部分。 | |
6.安全性评价(如生物相容性、电气安全性等) 关注:生物相容性评价、GB 9706.1和GB 9706.218的适用性。 | |
7.产品符合的国家/行业标准 | |
8.适用范围:关注:使用部位的差异。 (1)适用人群 (2)适用部位 (3)与人体接触方式 (4)适应症 (5)适用的疾病阶段和程度 (6)使用环境 | |
9.使用方法 关注:使用方式的差异。 | |
10.禁忌症 关注:临床使用范围的差异。 | |
11.防范措施和警告 关注:临床使用风险点的差异。 | |
12.灭菌/消毒方式 关注:方法的差异,需对比所有采用的方法。 | |
13.包装 关注:是否是一次性包装,由包装差异引入的临床风险。 | |
14.标签 关注:随附资料差异。 | |
15.产品说明书 关注:随附资料差异。 |
四、差异性评价
申报器械和对比器械之间存在差异时,首先需要分析差异会对产品性能有什么影响。例如光学参数之间存在差异,但是申报器械的光学参数指标优于对比器械,则可认为申报器械的图像质量满足预期的临床应用要求。光学参数指标差于对比产品,或者无法通过测试数据等说明差异性部分不会对申报器械的图像质量产生不利的影响,则需要结合风险受益分析,必要时提供基于动物试验的图像样本予以确认申报产品的图像质量能满足临床需求。
机械参数有差异时,例如申报器械与对比器械的插入部最大直径不同。申报器械比对比器械插入部最大直径小,直径变小可以优化操作性能但可能影响图像质量,需明确该图像质量能否满足临床需求;申报器械比对比器械插入部最大直径大,需分析该较大直径对人体解剖结构的适应性,并提供相应的支持性证据,比如具有内窥镜诊疗工作经验的专科医师通过模型试验和/或动物试验对该操作性能进行评价,确认该操作性能能否满足临床需求。
